Setelah kelemahan dalam teori atom Thomson ditemukan, dan Thomson tidak dapat menjelaskan kelemahan tersebut, ahli kimia mulai merancang teori atom baru yang bisa diterima berdasarkan sifat-sifat atom yang sudah ditemukan waktu itu.
Ahli kimia selanjutnya yang mengajukan teori atom setelah Thomson adalah Rutherford.
Melalui artikel ini, mari kita bahas secara lengkap dasar percobaan, poin-poin dan kelemahan dari teori atom Rutherford.
Dasar Percobaan Teori Atom Rutherford
Dalam suatu percobaan, Rutherford menembak lempengan tipis emas menggunakan partikel alfa yang bermuatan positif dan bergenergi tinggi. Lempengan emas yang ditembak tersebut sangat tipis sehingga waktu itu dianggap hanya tersusun atas beberapa lapisan atom saja.
Kemudian, disekeliling lempengan tipis emas tersebut diberi dinding yang terbuat dari ZnS {seng sulfida}. Dinding ini mengalami fluoresensi jika terkena partikel alfa sehingga betindak sebagai indikator.
Saat Rutherford melakukan percobaan ini, elektron dan proton sudah ditemukan. Namun, bagaimana posisi keduanya di dalam atom yang masih perlu dijelaskan.
Ketika Rutherford menembak lempengan tipis emas menggunakan partikel alfa, ada 3 hal yang diamatinya, yaitu sebagai berikut:
1. Sebagian besar partikel alfa bergerak lurus menembus lempengan tipis emas.
2. Sebagian kecil partikel alfa dibelokkan oleh lempengan tipis emas sehingga tidak bergerak lurus.
3. Sebagian kecil partikel alfa lainnya dipantulkan oleh lempengan emas dengan sudut mencapai 180 derajat.
Penjelasan Rutherford Tentang Hasil Percobaan Penembakan Lempengan Tipis Emas Oleh Partikel Alfa.
1. Sebagian besar partikel alfa yang bermuatan positif bergerak lurus menembus lempengan emas. Menurut Rutherford, hal ini menunjukkan bahwa sebagian besar atom terdiri dari ruang hampa sehingga partikel alfa dapat menembus atom dengan mudah.
2. Adanya sebagian kecil partikel alfa yang dibelokkan menunjukkan bahwa partikel ini mendekati suatu bagian di dalam atom yang bermuatan positif proton sehingga keduanya saling tolak menolak. Akibat tolakan tersebut, partikel alfa yang tadinya bergerak lurus akan membelok. Karena hanya ada sedikit partikel alfa yang dibelokkan, maka bagian positif dari atom ini terletak pada bagian tertentu saja di dalam atom, bukan menyebar seperti yang dikatakan Thomson.
3. Peristiwa sebagian kecil partikel alfa dipantulkan oleh lempengan emas disebabkan karena partikel alfa menabrak bagian positif dari atom, yaitu proton. Karena mereka bertabrakan, maka partikel alfa dipantulkan dengan sudut yang jauh lebih besar. Peristiwa yang ketiga ini semakin memperkuat anggapan Rutherford bahwa di dalam atom terdapat partikel positif yang terlertak di bagian tertentu. Rutherford kemudian menyebutnya sebagai inti atom yang di dalamnya terdapat partikel bermuatan positif.
Berdasarkan penjelasan diatas, maka Rutherford menyusun teori atomnya.
Poin-Poin Dalam Teori Atom Rutherford
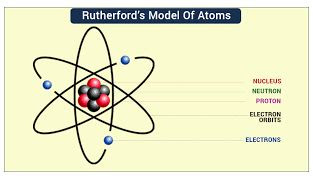
1. Atom terdiri dari partikel bermuatan positif yang disebut dengan proton dan massa atom terpusat pada bagian tertentu di dalam atom yang disebut dengan inti atom. Ukuran inti atom sangatlah kecil.
2. Inti atom dikelilingi oleh partikel bermuatan negatif yang disebut dengan elektron. Elektron bergerak mengelilingi inti dalam jalur yang melingkar dan dengan kecepatan tinggi.
3. Secara keseluruhan atom bermuatan netral, karena jumlah elektron dan protonnya sama sehingga dapat menyeimbangkan muatan. Ada gaya elektrostatik yang kuat di dalam atom sehingga dapat menahan elektron dan proton ditempatnya.
Model Atom Rutherford
Kelemahan Teori Atom Rutherford
1. Rutherford tidak bisa menjelaskan tentang kestabilan atom. Berdasarkan salah satu poin dalam teori atom Rutherford, elektron bergerak mengelilingi inti atom dengan kecepatan yang sangat tinggi pada suatu lintasan. Namun, Maxwell menjelaskan bahwa suatu partikel bermuatan yang bergerak dengan kecepatran tinggi akan melepaskan radiasi elektromagnetik sehingga lama kelamaan, energi yang dikandung oleh elektron akan habis dan jatuh ke inti. Jika itu terjadi, maka atom akan musnah. Namun, atom masih tetap ada dan tidak pernah musnah.
2. Teori atom Rutherford belum lengkap karena dalam teorinya, Rutherford tidak menejlaskan sedikitpun bagaimana susunan elektron di dalam lintasannya. Nanti, ahli kimia selanjutnya yaitu Bohr lah yang memapu menjelaskan hal tersebut sehingga menggagalkan teori atom Rutherford.
Ahli kimia selanjutnya yang mengajukan teori atom setelah Thomson adalah Rutherford.
Melalui artikel ini, mari kita bahas secara lengkap dasar percobaan, poin-poin dan kelemahan dari teori atom Rutherford.
Dasar Percobaan Teori Atom Rutherford
Dalam suatu percobaan, Rutherford menembak lempengan tipis emas menggunakan partikel alfa yang bermuatan positif dan bergenergi tinggi. Lempengan emas yang ditembak tersebut sangat tipis sehingga waktu itu dianggap hanya tersusun atas beberapa lapisan atom saja.
Kemudian, disekeliling lempengan tipis emas tersebut diberi dinding yang terbuat dari ZnS {seng sulfida}. Dinding ini mengalami fluoresensi jika terkena partikel alfa sehingga betindak sebagai indikator.
Saat Rutherford melakukan percobaan ini, elektron dan proton sudah ditemukan. Namun, bagaimana posisi keduanya di dalam atom yang masih perlu dijelaskan.
Ketika Rutherford menembak lempengan tipis emas menggunakan partikel alfa, ada 3 hal yang diamatinya, yaitu sebagai berikut:
1. Sebagian besar partikel alfa bergerak lurus menembus lempengan tipis emas.
2. Sebagian kecil partikel alfa dibelokkan oleh lempengan tipis emas sehingga tidak bergerak lurus.
3. Sebagian kecil partikel alfa lainnya dipantulkan oleh lempengan emas dengan sudut mencapai 180 derajat.
Penjelasan Rutherford Tentang Hasil Percobaan Penembakan Lempengan Tipis Emas Oleh Partikel Alfa.
1. Sebagian besar partikel alfa yang bermuatan positif bergerak lurus menembus lempengan emas. Menurut Rutherford, hal ini menunjukkan bahwa sebagian besar atom terdiri dari ruang hampa sehingga partikel alfa dapat menembus atom dengan mudah.
2. Adanya sebagian kecil partikel alfa yang dibelokkan menunjukkan bahwa partikel ini mendekati suatu bagian di dalam atom yang bermuatan positif proton sehingga keduanya saling tolak menolak. Akibat tolakan tersebut, partikel alfa yang tadinya bergerak lurus akan membelok. Karena hanya ada sedikit partikel alfa yang dibelokkan, maka bagian positif dari atom ini terletak pada bagian tertentu saja di dalam atom, bukan menyebar seperti yang dikatakan Thomson.
3. Peristiwa sebagian kecil partikel alfa dipantulkan oleh lempengan emas disebabkan karena partikel alfa menabrak bagian positif dari atom, yaitu proton. Karena mereka bertabrakan, maka partikel alfa dipantulkan dengan sudut yang jauh lebih besar. Peristiwa yang ketiga ini semakin memperkuat anggapan Rutherford bahwa di dalam atom terdapat partikel positif yang terlertak di bagian tertentu. Rutherford kemudian menyebutnya sebagai inti atom yang di dalamnya terdapat partikel bermuatan positif.
Berdasarkan penjelasan diatas, maka Rutherford menyusun teori atomnya.
Poin-Poin Dalam Teori Atom Rutherford
1. Atom terdiri dari partikel bermuatan positif yang disebut dengan proton dan massa atom terpusat pada bagian tertentu di dalam atom yang disebut dengan inti atom. Ukuran inti atom sangatlah kecil.
2. Inti atom dikelilingi oleh partikel bermuatan negatif yang disebut dengan elektron. Elektron bergerak mengelilingi inti dalam jalur yang melingkar dan dengan kecepatan tinggi.
3. Secara keseluruhan atom bermuatan netral, karena jumlah elektron dan protonnya sama sehingga dapat menyeimbangkan muatan. Ada gaya elektrostatik yang kuat di dalam atom sehingga dapat menahan elektron dan proton ditempatnya.
Model Atom Rutherford
Kelemahan Teori Atom Rutherford
1. Rutherford tidak bisa menjelaskan tentang kestabilan atom. Berdasarkan salah satu poin dalam teori atom Rutherford, elektron bergerak mengelilingi inti atom dengan kecepatan yang sangat tinggi pada suatu lintasan. Namun, Maxwell menjelaskan bahwa suatu partikel bermuatan yang bergerak dengan kecepatran tinggi akan melepaskan radiasi elektromagnetik sehingga lama kelamaan, energi yang dikandung oleh elektron akan habis dan jatuh ke inti. Jika itu terjadi, maka atom akan musnah. Namun, atom masih tetap ada dan tidak pernah musnah.
2. Teori atom Rutherford belum lengkap karena dalam teorinya, Rutherford tidak menejlaskan sedikitpun bagaimana susunan elektron di dalam lintasannya. Nanti, ahli kimia selanjutnya yaitu Bohr lah yang memapu menjelaskan hal tersebut sehingga menggagalkan teori atom Rutherford.

0 Komentar untuk "Teori Atom Rutherford: Dasar Percobaan, Poin-Poin, dan Kelemahannya"